希少疾患の知見から神経発達症の包括的理解へ
当研究室は2024年4月に設立され、神経発達症の病態解明を目指し、生命科学実験(Wet)と大規模データ解析(Dry)を統合した研究を展開しています。とくに遺伝的背景が明確な希少疾患について、臨床と基礎医学の双方のアプローチを通じて、神経発達症の包括的理解を目指しています。神経発達症の発症には遺伝要因と環境要因の双方が関与しており、その病態は極めて異質性が高いことが知られています。このため、遺伝的背景が明確な希少疾患を対象とした研究が近年注目を集めています。その代表例として、ウィリアムズ症候群が挙げられます。ウィリアムズ症候群の特徴的な社交性は、「カクテルパーティー様」とも形容され、自閉スペクトラム症(ASD)とは対照的な高い社会性を示します。このことから、社会性行動の神経基盤を解明するうえで極めて重要なモデル疾患として研究が進められています。
ウィリアムズ症候群
ウィリアムズ症候群(Williams syndrome、またはWilliams-Beuren syndrome)は約1万人に1人にみられる希少疾患です。1960年代初めに2人の循環器科医Williams 氏(ニュージーランド)と Beuren 氏(ドイツ)がそれぞれ別々に発表した症例(特徴的な顔貌と知的発達の遅れを伴う大動脈弁上狭窄症)が発見のきっかけとなったことから、ウィリアムズ・ボイレン症候群(Williams-Beuren syndrome)とも呼ばれます。 ウィリアムズ症候群は、7番染色体の片側に位置する微細な領域の欠失によって生じます(図)。
その臨床像は多彩で、妖精様と称される特徴的な顔貌、大動脈弁上狭窄などの心血管異常、内分泌異常、多弁で陽気なカクテルパーティー様と呼ばれる高い社交性、知的発達症、視覚認知障害、注意欠如・多動症(ADHD)、聴覚過敏などが報告されています。しかし、すべての患者が同じ症状を呈するわけではなく、年齢とともに症状が変化することも知られています。
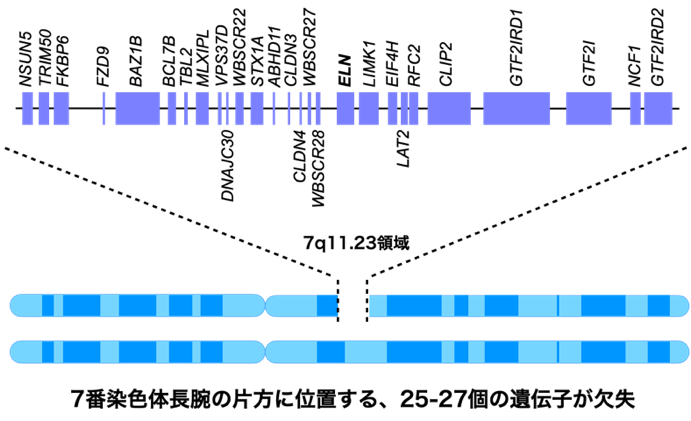
このウィリアムズ症候群では、①病態機序(表現型と遺伝子の関係は完全には未解明)、②表現型の多様性(症状の個人差が大きい理由は不明)、③長期的な臨床経過(加齢に伴う合併症や予後が不明)、④治療法(根本的な治療法だけでなく、合併症に対する薬物治療のエビデンスも未確立)など、多くの課題があります。
私たちは、これら課題の解明を目指し、ウィリアムズ症候群の専門外来を立ち上げるとともに、家族会や国内外の異分野の研究者と連携しながら研究を展開しています。これまでに私たちは、ウィリアムズ症候群では、欠失された遺伝子以外の遺伝子群も病態に関与しており、特に免疫系に関連する遺伝子群が重要であること(Kimura et al, J Child Psychol Psychiatry 2019)。DNAのメチル化異常も病態に関与しており、特に神経発生や発達に関わる遺伝子のメチル化が高まり、その働きが抑えられていること(Kimura et al, Neuropsychopharmacology 2020)、さらに、有力な老化の指標である、DNAメチル化レベルから予測される生物学的年齢(エピジェネティクス年齢)を用いて、ウィリアムズ症候群では加齢が促進していることを明らかにしました(Okazaki, Kimura et al, J Child Psychol Psychiatry 2022)。
ゼブラフィッシュ
近年のゲノム解析技術の発展により、欧米を中心に、大規模な臨床検体を活用した神経発達症のゲノム医学研究が進められ、多くの関連遺伝子が同定されてきました。しかし、同定された遺伝子の多くは発症頻度が低く、その機能解析が十分に進んでいないため、病態の包括的な理解には至っていません。そこで私たちは、ゼブラフィッシュをモデル生物として用いた神経発達症関連遺伝子の機能解析を推進しています。ゼブラフィッシュは、ヒトと高い遺伝的相同性を持ち、マウスに比べて飼育コストが低いことに加え、ゲノム編集技術を用いたモデル作成や大規模な行動解析に適しているといった利点を有しています。私たちは、このゼブラフィッシュを用いてADHD治療薬であるメチルフェニデート(MPH)とアトモキセチン(ATX)の効果を比較した研究を行い、MPHとATHは対照的な不安様行動を呈すること、共通して脂質代謝に関連した遺伝子群に関わることを明らかにしました(Suzuki et al, Mol Brain 2020)。

バイオマーカー
自閉スペクトラム症(ASD)や注意欠如・多動症(ADHD)をはじめとする神経発達症は、近年その診断率が上昇しており、教育や就労の場面において大きな社会的課題となっています。しかし、現在の診療では、問診や診察を基に診断基準に照らし合わせて診断・治療が行われており、生物学的所見に基づく客観的・定量的な診断方法が確立されていないのが現状です。そのため、より精密な診断や重症度評価を可能とするバイオマーカーの開発が求められています。私たちはこれまでに、microRNAやDNAメチル化に着目したASDのバイオマーカー探索研究を進めてきました(Nakata et al, Mol Brain 2019; Kimura et al, Sci Rep 2019)。
主な研究テーマ
1)神経発達症における加齢に伴う特性変化の解明とその分子基盤の探究
2)ウィリアムズ症候群の多様な表現型を生み出す要因の解明と病態の包括的理解
3)ゼブラフィッシュを活用したADHD関連遺伝子の機能解析と疾患メカニズムの解明
4)栄養・腸内細菌叢と神経発達症の相互作用に関する統合的研究
5)神経発達症の客観的診断・重症度評価に向けたバイオマーカーの探索
6)神経発達症の感覚特性に着目した臨床研究
当研究室では神経発達症の病態解明に向けて、様々なアプローチを統合しながら研究を展開しています。
しかし、私たちの研究テーマはこれらに限定されるものではありません。新たな視点を持ち、ご自身のアイデアを活かして研究に挑戦したい方を歓迎します。